La structure de l'atome
1 La naissance de la théorie atomique
1.1 La loi de LAVOISIER
LAVOISIER (1743-guillotiné en 1794) a, par expérience, établit la loi de la conservation de la matière qui dit que "la masse totale des produits formés à l'issue d'une réaction chimique est égale à la masse totale des réactifs consommés".
Attention néanmoins au fait qu'il peut exister des réactifs en excès qui ne participent pas à la réaction, et surtout au fait que certains réactifs ou certains produits sont gazeux et parfois difficilement détectables. Par exemple, la combustion du bois ou de l'essence libère deux gaz incolores, le dioxyde de carbone et la vapeur d'eau, et pourrait faire oublier qu'un réactif également gazeux et incolore intervient: l'oxygène de l'air!
1.2 La loi de PROUST
En faisant réagir de l'oxygène et du magnésium, on constatera que les masses des deux quantités réagissant effectivement sont toujours dans un rapport de 60% de magnésium pour 40% d'oxygène
PROUST (1754-1826) a, par expérience, établit la loi des proportions définies, qui dit que "le rapport des masses de chaque réactif qui ont été consommées est constant".
1.3 La loi de DALTON
Il arrive que, selon les conditions, deux éléments puissent se combiner en différentes proportions. Par exemple, C et O2 peuvent se combiner différemment pour donner deux gaz différents: le monoxyde de carbone CO ou le dioxyde de carbone CO2. Ces deux réactions présentent chacune un rapport massique des réactifs constant.
Mais DALTON a relevé un fait curieux, qu'il a exprimé dans la loi des proportions multiples: "les différentes masses d'un réactif réagissant avec une même masse de l'autre réactif sont toujours dans un rapport de nombres entiers".
1.4 Le modèle de DALTON
Des observations formalisées dans sa célèbre loi, DALTON a déduit la preuve de l'existence, pour chaque élément connu, d'une entité indivisible: l'atome.
Selon le modèle de DALTON, établi pour répondre aux trois lois précédentes provenant de l'expérimentation, "les atomes sont des particules simples, infractionnables et indestructibles; il en existe de diverses sortes, qui se différencient par leur masse et qui correspondent chacune à un élément chimique, représenté par un symbole".
Exemple: H est le symbole de l'hydrogène, O est le symbole de l'oxygène.
Notons qu'un symbole est constitué soit d'une lettre majuscule (par exemple C pour le carbone) soit de deux lettres dont la première est une majuscule et la seconde une minuscule (par exemple Co pour le cobalt).
Si la majorité des symboles rappellent l'initiale de l'élément, certains peuvent paraître surprenants; ils dérivent du nom de l'élément dans une langue étrangère: par exemple, N est le symbole chimique de l'azote (pour "Nitrogen" en anglais), K est le symbole chimique du potassium (pour "Kalium" en allemand) et Na est le symbole chimique du sodium (pour "Natrium" en allemand).
Les noms français des éléments, quant à eux, sont parfois d'origine curieuse: le terme "arsenic", par exemple, dérive de l'orpiment, en réalité du sulfure d'arsenic, utilisé comme colorant dans l'antiquité et qui était vendu par les arabes sous le nom d'"az-zernik"; "cobalt" vient du nom allemand "cobold" signifiant "lutin malfaisant"; "gallium" vient du nom latin "gallus" sigifiant "coq" tout simplement car son inventeur s'appelait LECOQ DE BOISBAUDRAN...
1.5 Atomes et molécules
La matière qui nous compose et nous entoure est divisible: une craie peut être brisée, et la poussière qu'elle laisse possède les mêmes propriétés que le bâton de craie tout entier. La fumée de cigarette révèle sa structure au microscope: de minuscules fragments solides en suspension dans l'air.
La plus petite particule de matière qui conserve les propriétés de l'ensemble est la molécule. La pierre bleue est, par exemple, formée de molécules de calcaire; les nuages ou l'eau sont formés de molécules d'eau; nos ongles ou nos cheveux sont formés de molécules de kératine; la farine est formée de molécules d'amidon, etc.
Les molécules, invisibles au microscope tellement elles sont petites, sont composées d'atomes semblables ou différents unis par des liaisons chimiques. La formule chimique d'une substance donne la composition de chacune de ses molécules, en indiquant la nature et le nombre d'atomes de chacune d'elles. Par exemple, l'eau de formule H2O est faite de molécules dont chacune est constituée par l'union d'un atome d'oxygène et de deux atomes d'hydrogène. Soulignons que le nombre d'atomes de chaque sorte figurant dans une molécule est indiqué au moyen d'un nombre placé en indice et derrière le symbole de l'atome!
Par opposition aux corps simples, composés d'une seule espèce atomique ( H2, N2, O2, O3,... ), les corps composés sont composés de plusieurs espèces atomiques différentes et sont dits binaires, ternaires ou quaternaires selon qu'ils contiennent respectivement deux, trois ou quatre espèces atomiques. Il s'agit de ne pas confondre cette distinction avec celle opposant les corps purs, composés d'une seule espèce moléculaire, aux mélanges.
1.6 La réaction chimique
En d'autres termes, la loi de la conservation de la matière précise qu'au cours d'une réaction chimique, les atomes ne sont ni créés, ni détruits: il s'en trouve autant de chaque sorte dans l'ensemble des réactifs que dans l'ensemble des produits.
En outre, puisque chaque élément chimique présente une masse constante, la loi des proportions définies nous apprend que les réactifs réagissent selon un rapport de nombres d'atomes invariable pour une réaction donnée.
La réaction chimique, puisqu'elle change néanmoins la nature des substances mises en jeu, est donc un réarrangement des atomes entre eux pour constituer de nouvelles molécules.
Exemple: H2 + Cl2 = 2 HCl est une réaction chimique au cours de laquelle les atomes d'hydrogène, associés par deux dans les molécules d'un réactif, et les atomes de chlore, associés par deux dans les molécules de l'autre réactif, s'individualisent puis se réarrangent pour former un nouveau produit, dont chaque molécule est faite de l'union d'un atome d'hydrogène et d'un atome de chlore.
1.7 Equilibration chimique
Afin de satisfaire à la loi de LAVOISIER, on équilibrera toute réaction chimique en déterminant des cœfficients moléculaires tels que le "nombre d'atomes de chaque élément parmi tous les réactifs consommés se retrouve identiquement parmi tous les produits formés".
Voyons un exemple concret. Soit la réaction :
Sb2S3 + HCl = H3SbCl6 + H2S
Il s'agit de poser des cœfficients moléculaires, dits cœfficients stœchiométriques tels que l'on retrouve autant d'atomes de Sb parmi les réactifs et parmi les produits, autant d'atomes de S parmi les réactifs et parmi les produits, autant d'atomes de H parmi les réactifs et parmi les produits, autant d'atomes de Cl parmi les réactifs et parmi les produits.
On commencera par équilibrer les éléments que l'on ne retrouve que dans un seul réactif et un seul produit. Il y a 2 atomes de Sb parmi les réactifs: on formera donc 2 molécules de H3SbCl6 contenant chacune 1 atome de Sb.
Sb2S3 + HCl = 2 H3SbCl6 + H2S
Avec les 3 atomes de S contenus dans une molécule de Sb2S3, on formera 3 molécules de H2S, contenant chacune 1 atome de S, étant bien entendu qu'il est défendu de modifier la formule chimique (c'est-à-dire la nature) des réactifs ou des produits.
Sb2S3 + HCl = 2 H3SbCl6 + 3H2S
Pour former 2 molécules de H3SbCl6, contenant chacune 6 atomes de Cl, il faut 12 atomes de Cl: il convient donc de prévoir parmi les réactifs 12 atomes de Cl, soit 12 molécules de HCl contenant chacune 1 atome de Cl.
Sb2S3 + 12 HCl = 2 H3SbCl6 + 3H2S
On vérifiera enfin que, pour le dernier élément, soit l'hydrogène, il y a effectivement autant d'atomes parmi les réactifs que parmi les produits:
(12 X 1) = (2 X 3) + (3 X 2)
Lorsque l'équation paraît plus difficile à équilibrer, par exemple:
HClO4 + P4O10 = H3PO4 + Cl2O7
...on pose pour cœfficients des variables a, b, c, d pour lesquelles on établira des relations logiques de proportionnalité basées sur la loi de LAVOISIER:
a HClO4 + b P4O10 = c H3PO4 + d Cl2O7
Sachant qu'il y a autant de H parmi les réactifs que parmi les produits, on pose ax1 = cx3 soit a = 3c ; sachant qu'il y a autant de Cl parmi les réactifs que parmi les produits, on pose ax1 = dx2 soit a = 2d ; sachant qu'il y a autant de O parmi les réactifs que parmi les produits, on pose ax4 + bx10 = cx4 + dx7 soit 4a+10b = 4c+7d ; sachant enfin qu'il y a autant de P parmi les réactifs que parmi les produits, on pose bx4 = cx1 soit 4b = c.
En résumé on a apparemment un système de quatre équations à quatre inconnues:
L'équation chimique correspondant à une réalité, la loi de LAVOISIER doit pouvoir s'appliquer: il s'ensuit que si l'on équilibre pour tous les éléments sauf un, ce dernier est automatiquement équilibré (dans le cas contraire, l'équation serait impossible à équilibrer et donc irréelle). On a donc, sur l'ensemble des égalités mathématiques, une expression redondante: on pourra éliminer une équation dans laquelle aucun cœfficient n'apparaît pour l'unique fois (dans notre exemple, a, b, c et d apparaissant dans d'autres équations, la troisième expression 4a+10b = 4c+7d sera avantageusement ignorée). On obtient:
Si l'on pose que le plus petit cœfficient (ici b) est égal à l'unité, on en déduit:
L'équation est ainsi équilibrée :
12 HClO4 + P4O10 = 4 H3PO4 + 6 Cl2O7
Dans certains cas, plutôt que de traîner de très nombreuses équations, il est utile de déterminer rapidement les relations proportionnelles entre certains cœfficients stœchiométriques. Dans l'équation:
K4Fe(CN)6 + H2SO4 + H2O = K2SO4 + FeSO4 + (NH4)2SO4 + CO
...le cœfficient de K2SO4 est nécessairement le double de celui de K4Fe(CN)6 (afin d'équilibrer le nombre d'atomes de K), le cœfficient de FeSO4 est nécessairement le même que celui de K4Fe(CN)6 (afin d'équilibrer le nombre d'atomes de Fe), le cœfficient de (NH4)2SO4 est nécessairement le triple de celui de K4Fe(CN)6 (afin d'équilibrer le nombre d'atomes de N), le cœfficient de CO est nécessairement le sextuple de celui de K4Fe(CN)6 (afin d'équilibrer le nombre d'atomes de C). On démarrera ainsi les équations de proportionnalité à partir de l'équation:
a K4Fe(CN)6 + b H2SO4 + c H2O = 2a K2SO4 + a FeSO4 + 3a (NH4)2SO4 + 6a CO
L'équation équilibrée se présentera ainsi :
K4Fe(CN)6 + 6 H2SO4 + 6 H2O = 2 K2SO4 + FeSO4 + 3 (NH4)2SO4 + 6 CO
2 La structure de l'atome
2.1 Structure du noyau atomique
L'atome est constitué d'un noyau central, où est localisée la quasi-totalité de la masse de l'atome, et d'un nuage d'électrons.
Le noyau est composé de protons, particules lourdes et chargées électriquement positivement, et de neutrons, particules lourdes sans aucune charge électrique. Comme les protons et les neutrons sont les particules du noyau, on leur donne le nom de nucléons (du latin "nucleus" = le noyau).
Le nombre "Z" de protons contenus dans le noyau d'un atome est caractéristique de la nature de l'élément et constant pour celui-ci. Il est appelé nombre atomique de l'élément. Il suffit de consulter le tableau périodique de MENDELEEV pour connaître le nombre atomique de chacun des éléments existants. Par exemple, tout atome de carbone possède 6 protons car son nombre atomique "Z" égale 6, et inversement tout atome possédant 6 protons est un atome de carbone. Lorsqu'on désire rappeler le nombre atomique d'un élément, "Z" s'écrit en indice, en bas à gauche du symbole de l'élément.
Le nombre "A", nombre de masse ou masse atomique d'un atome, correspond au nombre de particules lourdes, ou nucléons, que contient son noyau (la masse d'un proton est presqu'égale à celle d'un neutron). Ce nombre est la somme du nombre de protons "Z" et du nombre de neutrons. On l'inscrit en haut et à gauche du symbole de l'atome.
Par exemple, 13756Ba représente un atome de baryum possédant 56 protons et 81 neutrons (137 - 56 = 81).
2.2 Les isotopes
2.2.1 Définition
Deux isotopes d'un même élément sont deux atomes de même nombre atomique (donc de même nature), mais de nombres de masse différents: présentant le même nombre de protons, ces deux atomes ont néanmoins une masse différente car ils ne possèdent pas le même nombre de neutrons.
Il existe, par exemple, trois isotopes de l'hydrogène: 1H est de très loin l'isotope le plus abondant, mais on trouve aussi, en très petite quantité l'hydrogène deutérium 2H (qui possède un neutron) et l'hydrogène tritium 3H (qui possède deux neutrons).
2.2.2 Méthode de datation au carbone 14
Parmi les nombreux éléments chimiques, le carbone présente un intérêt tout particulier puisqu'il constitue la base de la nature vivante. Cet élément comprend trois isotopes: le carbone 12 (12C), le carbone 13 (13C) et le carbone 14 (14C).
Si les isotopes d'un même corps ont les mêmes propriétés chimiques, ils diffèrent par certaines de leurs propriétés physiques. Dans le cas du carbone, 12C et 13C sont stables, tandis que 14C est radioactif. Tout radioélément a la propriété de se détruire peu à peu en donnant naissance à un ou plusieurs corps. La vitesse de cette décroissance radioactive est exprimée par la notion de période de demi-vie: il s'agit du laps de temps nécessaire pour voir se désintégrer la moitié des atomes initialement présents. Pour le 14C, la période de demi-vie "T" = 5730 ans.
Dans le cas du 14C, on observe la désintégration suivante:
146C = 147N + rayonnement bêta avec T = 5730 ans
Comme la concentration en 14C d'un organisme vivant égale celle de son environnement (puisque celui-ci renouvèle ses composés à partir des molécules qui l'entourent), dès sa mort, sa concentration en 14C diminue avec le temps: 50 % a disparu au terme de 5730 ans, 75 % au bout de 11460 ans, etc. En mesurant la concentration résiduelle en 14C d'un fossile, on peut, par calcul, dater la mort de la plante ou de l'animal .
On part bien sûr de l'hypothèse que la concentration en 14C dans l'environnement est restée constante au cours des temps, ce qui est vérifié par l'observation de la façon dont le 14C est généré: il s'agit de l'action des rayons cosmiques (principalement composés de protons) sur les noyaux d'atomes d'azote de l'air. Néanmoins, deux phénomènes récents ont influencé cette concentration: à partir de 1850 jusqu'en 1930, la concentration en 14C a diminué (baisse de 4%) à cause de la combustion industrielle massive de carbone fossile non actif (charbon et pétrole); depuis 1954, la teneur en 14C a rapidement rattrapé puis dépassé sa valeur normale à la suite des nombreux essais nucléaires.
On est actuellement capable de dater, grâce au 14C, des objets et fossiles vieux de 200 à 70 000 ans.
2.2.3 Rayonnements alpha et bêta
Comme nous venons de la voir avec la désintégration radioactive du 14C, le rayonnement émis peut correspondre à un flux d'électrons provenant chacun de la désintégration d'un neutron en un proton supplémentaire et un électron éjecté. On retrouve ce rayonnement bêta dans la désintégration d'un élément qui conserve néanmoins sa masse par exemple celle de l'uranium 235 en neptunium de même masse:
23592U = 23593Np + rayonnement bêta
Il existe aussi un rayonnement alpha qui lui correspondant à l'émission de noyaux d'hélium 4 (4He), soit un ensemble de deux neutrons et deux protons. Dans ce cas, à la fois le nombre atomique, donc la nature, et la masse de l'élément changent. C'est le cas lors de la désintégration de l'uranium 234 en thorium 230:
23492U = 23090Th + 42He
2.3 Le tableau périodique
Dès le début du XIXè siècle, plusieurs auteurs tentèrent de mettre de l'ordre dans la liste disparate des éléments connus. Certains rangèrent les éléments par masse atomique croissante, d'autres découvrirent qu'au fil de cet arrangement les atomes présentaient périodiquement les mêmes propriétés chimiques. C'est ainsi qu'en 1869 MENDELEÏEV disposa les éléments dans un tableau à sept colonnes, par ordre de masse atomique croissante et de sorte que tous les éléments d'une même colonne présentent les mêmes propriétés chimiques. Ces colonnes constituent les familles d'éléments chimiques: les alcalins (famille 1), les alcalino-terreux (famille 2), les terreux (famille 3), les carbonides (famille 4), les azotides (famille 5), les sulfurides (famille 6) et les halogènes (famille 7).
En réalisant cette classification, le savant russe fut obligé, pour respecter l'analogie entre les éléments, de laisser vides des cases correspondant à des éléments encore inconnus à son époque. Il ne se borna pas à prédire l'existence de tels éléments, mais décrivit, avant même de les connaître, les propriétés de ces atomes. Plus tard, ses prédictions furent vérifiées avec une telle précision que ce fut pour MENDELEÏEV le triomphe.
Les groupes 1 à 7 sont scindés. Considérons, par exemple, l'élément cuivre Cu. Certaines propriétés du cuivre sont analogues à celles du potassium K. Pour mettre cette analogie en évidence, on place l'élément cuivre dans le groupe 1. Comme l'argent (Ag) et l'or (Au) ont, eux aussi, des propriétés analogues respectivement à celles du rubidium (Rb) et du césium (Cs), on place l'argent et l'or également dans le groupe 1. Il en résulte que le groupe 1 possède deux colonnes: 1a et 1b. Il en va de même pour les autres groupes, jusqu'au groupe 7 y compris.
Initialement, le cuivre était placé dans la même colonne que le potassium, en bas à droite de celui-ci, l'argent en bas à droite du rubidium et l'or en bas à droite du césium. On utilise actuellement plutôt le tableau à périodes longues, faisant ressortir davantage la dépendance des propriétés du nombre atomique.
Les éléments sont actuellement rangés en 8 colonnes, les 7 premières furent baptisées par MENDELEÏEV "groupes naturels des éléments", la huitième colonne contenant des éléments inconnus à l'époque du savant et qui ne trouvent pas de place ailleurs: ce sont les "gaz rares".
Horizontalement, les éléments se rangent en 7 périodes. Les trois premières périodes sont des périodes courtes, comprenant, la première 2 éléments, les autres 8. Les quatrième, cinquième et sixième périodes sont des périodes longues, comprenant chacune une sous-période "b". La septième période est encore incomplète. Les éléments naturellement présents sur terre vont de l'hydrogène (Z = 1) à l'uranium (Z = 92). Au-delà de l'uranium, les éléments transuraniens sont des atomes artificiels, en ce sens qu'ils ne sont pas présents dans la nature, mais qu'on les obtient uniquement par des réactions nucléaires, provoquées au moyen de bombardements d'atomes.
2.4 Les électrons
2.4.1 Nombre d'électrons d'un atome
Autour du noyau gravitent des électrons, particules dotées d'une charge électrique négative (de valeur absolue égale à celle du proton) et de masse tellement petite qu'on pourra la négliger. En effet, la masse de l'électron est 1840 fois plus faible que celle d'un proton.
Dans un atome électriquement neutre (=non chargé), le nombre de charges négatives, donc d'électrons, égale le nombre de charges positives, donc de protons. Le nombre atomique Z renseigne dans ce cas le nombre d'électrons gravitant autour du noyau. Mais si le nombre Z est invariable pour un élément donné, le nombre d'électrons qu'il comprend peut varier.
Si un atome gagne 1 ou plusieurs électrons, il acquiert une charge électrique une ou plusieurs fois négative: on parle d'un anion. Si un atome perd 1 ou plusieurs électrons, il acquiert une charge électrique une ou plusieurs fois positive: on parle d'un cation. De façon générale, un ion est un atome (ou un groupe d'atomes) électriquement chargé, car le nombre d'électrons qu'il contient diffère du nombre de protons. La charge électrique s'inscrit en haut à droite du symbole chimique:
2.4.2 Structure du nuage électronique
2.4.2.1 Couche électronique et nombre quantique principal
Le fait que les éléments rangés selon le nombre atomique croissant accusent une périodicité dans leurs propriétés chimiques laisse prévoir qu'il existe une périodicité dans la façon dont les électrons périphériques, responsables des réactions chimiques lors des collisions entre atomes et donc des propriétés chimiques, sont répartis.
En 1913, BOHR élabora une théorie basée sur l'hypothèse selon laquelle "l'énergie d'un électron ne varie pas de façon continue, mais par bonds", comme une bille descendant les marches d'un escalier. En d'autres termes, l'électron ne peut se trouver que dans des états d'énergie bien déterminés, et il ne peut accroître ou diminuer son énergie, en sautant de niveaux, que par paquets ou quanta (= pluriel de "quantum"). Lorsque l'électron est à son niveau d'énergie le plus faible, on dit qu'il est à son niveau de base ou niveau fondamental.
L'hypothèse de BOHR a pris naissance du fait que les électrons excités redescendent à un niveau énergétique moindre (= niveau fondamental) en émettant la différence d'énergie sous forme de lumière. Or la décomposition de cette lumière montre une ou plusieurs raies de longueur d'onde bien précise, chacune correspondant à un quantum d'énergie perdu.
Ces niveaux d'énergie des électrons ou couches électroniques sont numérotés 1, 2, 3... à partir du niveau de base et le numéro d'ordre des différents niveaux est appelé nombre quantique principal.
Le nombre d'électrons dans les différents niveaux est limité à 2n2. Par conséquent il n'y aura pas plus de 2 électrons au niveau le plus bas (2 = 2 . 12 car n = 1), 8 électrons au niveau suivant (8 = 2 . 22 car n = 2), 18 électrons au maximum au niveau n = 3 (18 = 2 . 32 car n = 3), puis 32 électrons au maximum au niveau n = 4. Jusqu'ici, on ne connaît pas d'atome ayant un niveau d'énergie avec plus de 32 électrons. Les niveaux d'énergie correspondant à n = 1, n = 2,..., n = 7 sont appelés couches K, L, M, N, O, P, Q.
Lorsque l'on range les éléments selon leur masse atomique croissante, chacun d'eux possède un électron de plus que l'élément qui le précède. Dans l'atome d'hydrogène H (Z = 1), l'unique électron occupe la couche K. Dans l'atome d'hélium He (Z = 2), le second électron occupera aussi la couche K, et ceci la remplira complètement. La première couche étant complète avec l'hélium, le troisième électron du lithium Li (Z = 3) se placera dans la deuxième couche L et ainsi de suite jusqu'au néon Ne (Z = 10) qui saturera la deuxième couche avec 8 électrons. Ensuite viendra le remplissage progressif de la troisième couche M avec 1, 2, 3... électrons pour les atomes de sodium Na, magnésium Mg, aluminium Al...
On comprend dès lors la récurrence des propriétés chimiques des éléments. Les alcalins ont 1 électron sur la dernière couche, les alcalino-terreux 2, les terreux 3, les carbonides 4, les azotides 5, les sulfurides 6, les halogènes 7 et les gaz rares 8.
2.4.2.2 Sous-couche électronique et nombre quantique secondaire
A partir du potassium K (Z = 19), le remplissage des couches électroniques devient plus compliqué: alors que le 19è électron devrait occuper la 3è couche M encore incomplète, celui-ci se place curieusement sur la 4è couche N. Le 20è électron du calcium Ca (Z = 20) se place également dans la 4è couche, mais à partir du scandium Sc (Z = 21), le remplissage de la 3è couche se poursuit normalement jusqu'à saturation avec le zinc Zn (Z = 30).
A côté des éléments plaçant leur dernier électron (en comparaison avec l'élément précédent) dans la dernière couche (= éléments des groupes a), les éléments plaçant leur dernier électron dans l'avant-dernière couche (= éléments des groupes b) sont les éléments de transition: on les rencontre du scandium Sc au zinc Zn, de l'yttrium Y au cadmium Cd, du lanthane La au mercure Hg. On peut aussi définir les éléments de transition comme ceux dont l'avant-dernière couche n'est pas saturée d'électrons.
Notons que, du lanthane au lutétium Lu et à partir de l'actinium Ac, le dernier électron se place dans l'antépénultième couche: on parle, pour ces éléments aux propriétés tellement semblables qu'il est difficile de les séparer, de terres rares . On peut donc aussi définir les terres rares comme les éléments dont l'antépénultieme couche n'est pas saturée d'électrons. Ils se composent des lanthanides (sixième période) et des actinides (septième période), ces derniers étant tous radioactifs.
De telles irrégularités dans le remplissage des couches ou niveaux d'énergie électroniques nous obligent à admettre qu'il existe, dans chaque couche, des sous-niveaux d'énergie différents. Chaque couche doit être envisagée comme un ensemble de sous-couches, dont les énergies diffèrent. Le nombre de sous-niveaux est donné par la valeur du nombre quantique principal n: par exemple, la couche N (n = 4) comporte 4 sous-niveaux baptisés, par énergie croissante, s, p, d et f. Chacun des sous-niveaux énergétiques est déterminé par une valeur entière du nombre quantique secondaire k: k = 1 pour la sous-couche s de la 4è couche N (on appelle cette sous-couche 4s), k = 2 pour 4p, k = 3 pour 4d et k = 4 pour 4f.
Dans chaque sous-niveau, le nombre d'électrons est limité à:
Ces nombres seront logiquement déterminés dans la suite du cours.
2.4.2.3 Orbitale et nombre quantique magnétique
En outre, pour chaque sous-niveau, le nombre quantique magnétique m caractérise les diverses orbitales électroniques, dont chacune présente la même énergie électronique mais une orientation spatiale différente. Il y a, pour chaque sous-couche, [2 k - 1] orbitales de formes proches mais d'orientation différente.
Une orbitale ne doit pas être considérée comme une surface de révolution correspondant à la trajectoire de l'électron dans l'espace, mais plutôt comme une zone spatiale où l'électron a une probabilité de présence maximale à un instant déterminé. Il s'ensuit que l'électron peut être considérée comme un nuage diffus de charge électrique -1 réparti sur une orbitale.
2.4.2.4 Nombre d'électrons par orbitale et "spin"
En plus des trois nombres quantiques nécessaires pour décrire dans l'espace la position de l'électron par rapport au noyau, il existe un quatrième nombre quantique, interne à l'électron lui-même, qui décrit la rotation (on conserve souvent le mot anglais "spin") de l'électron sur lui-même. Etant donné le fait que cette rotation ne peut s'effectuer que dans le sens positif ou le sens négatif, ce nombre ne peut prendre que deux valeurs.
Le principe d'exclusion de PAULI précise que deux électrons d'un même atome ne peuvent avoir les mêmes quatre nombres quantiques. Dès lors, seuls deux électrons de spin opposés peuvent se trouver sur une même orbitale. Deux électrons qui ne diffèrent que par leur spin sont dits appariés et forment un doublet, tandis qu'un électron unique sur une orbitale est dit célibataire.
2.4.2.5 Les quatre nombres quantiques
En résumé:
On comprend mieux maintenant le nombre maximal d'électrons que peut accueillir un niveau d'énergie ou couche électronique :
A partir de la couche M, les sous-niveaux d'énergie se superposent partiellement . En effet, étant donné que l'orbitale s d'une couche présente un niveau d'énergie moindre que les orbitales d de la couche précédente, et que les orbitales s d'un niveau n sont même d'un moindre niveau d'énergie que les orbitales f de la couche [n-2], on conçoit mieux les irrégularités de remplissage des électrons par couches croissantes, l'électron s'installant toujours dans la sous-couche libre ayant l'énergie la plus faible.
Il n'existe pas d'élément dont le nombre d'électrons est tel qu'il nécessite le remplissage de toutes les orbitales 6d, à fortiori du sous-niveau 7p puis 8s, 5g (5è sous-niveau hypothétique de la 5è couche O)...
Tableau original illustrant l'ordre de remplissage des électrons dans les différentes couches et sous-couches atomiques.
Au fur et à mesure que l'on s'éloigne du noyau atomique, le quantum d'énergie nécessaire pour passer d'un sous-niveau énergétique au sous-niveau suivant ou au niveau suivant (c'est-à-dire l'énergie nécessaire pour passer d'un état fondamental à un état excité) diminue, puisque l'énergie nécessaire pour vaincre l'attraction de l'électron négatif par le noyau positif diminue avec la distance qui les sépare. Si l'excitation électronique est suffisamment importante, l'électron s'éloigne tant du noyau qu'il échappe à son attraction et est libéré: l'atome devient alors un ion positif.
2.4.3 Electrons périphériques et propriétés chimiques des éléments
Lorsque deux atomes se rencontrent et s'unissent éventuellement, ce sont bien sûr les électrons périphériques, c'est-à-dire ceux de la dernière couche, qui interviennent. Ce sont donc ces électrons de valence qui régissent la réactivité et les propriétés chimiques des atomes. Le fait que toutes les terres rares aient des propriétés chimiques extrêmement semblables confirme cette hypothèse.
Les gaz rares, nobles ou inertes, éléments de la dernière famille, sont tous caractérisés par une absence de réactivité. Leurs atomes ne s'unissent pas avec d'autres atomes. Les molécules sont monoatomiques, contrairement aux autres gaz qui sont diatomiques. Cette inertie chimique est due à l'extrême stabilité de leur structure électronique.
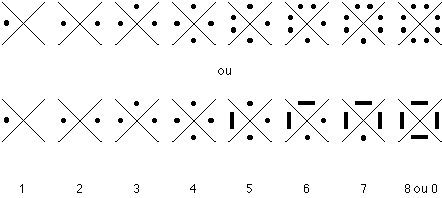
De cette constatation est née la théorie des octets, qui précise que le configuration à 8 électrons sur la couche périphérique (ce que l'on appelle un octet) correspond à une structure particulièrement stable que tout atome tendra à acquérir . LEWIS a mis au point une façon commode (voir tableau périodique au haut de chaque famille) de noter le nombre d'électrons périphériques, 8 au maximum quelle que soit la couche donc la période, en rappelant qu'ils sont dans ce cas appariés en 4 doublets, chacun occupant une orbitale (un doublet sur l'orbitale s et trois doublets sur les trois orbitales p):
Symboles de LEWIS